
Fotografía
Caucho
Energía
solar Polímeros
Antibióticos
Cambio
climático Petróleo
Emulsiones

Fotografía
Caucho
Energía
solar Polímeros
Antibióticos
Cambio
climático Petróleo
Emulsiones
El agente revelador tiene que ser un agente que reduzca el cloruro o el bromuro de plata a plata. Sin embargo, no todos los reductores que llenan este requisitos son agentes reveladores. El agente revelador tiene que reducir los granos de haluro de plata suficientemente expuestos con una rapidez substancialmente mayor que los granos que no han sido expuestos o que han sido expuestos insuficientemente. Algunos agentes reductores, como el estannito de sodio, reducen el haluro de plata expuesto y el no expuesto indiscriminadamente y por consiguiente no son agentes reveladores. Otros, como el sulfito de sodio, reaccionan con demasiada lentitud; el sulfito disuelve el haluro de plata antes que se produzca el revelado visible.
Se han hecho diversas tentativas para relacionar las propiedades termodinámicas, en particular los potenciales Redox, de los agentes reveladores con su acción como reveladores, pero sin ningún éxito notable. El potencial real de oxido-reduccion, Erev, puede medirse para los sistemas reversibles como el revelador de oxalatoferrato (II) y oxalatoferrato (III), que se ha utilizado en varias investigaciones. Es evidente que la reducción del haluro no podría producirse si no fuera termodinamicamente posible, y por consiguiente E = Erev - EAgtiene que ser una cantidad positiva. Sin embargo, Reinders y Beukers encontraron que para iniciar el revelado, E tiene que exceder un valor mínimo de 70-100 mv. Una vez que se ha iniciado el revelado, puede continuar en una solución en la cual Erev es simplemente mas positiva que EAg. Abribat, Pouradier y David encontraron que el valor critico de E necesario para iniciar el revelado varia algo con la naturaleza de la emulsión, pero obtuvieron el mismo valor critico para el revelado de imagen latente que para la formación de niebla. La razón para la existencia del valor critico aun no esta clara. Reinders supone que las minúsculas partículas de plata que forman la imagen latente son mas solubles que la plata maciza, y por consiguiente el valor real de EAg para el sistema de haluro de plata e imagen latente es mas positivo para el valor critico que el potencial determinado experimentalmente con un electrodo de plata maciza. Esta explicación exigiría una solubilidad de la plata latente 16-50 veces mayor que la plata maciza.
Se han sugerido varias correlaciones empíricas entre la capacidad del revelador y la estructura química, pero ninguna de ellas es completa, pero ninguna de ellas es completa. Entre los agentes reveladores inorgánicos de formula sugerida por Rzymkowski tiene una aplicabilidad bastante amplia a los que tienen un metal de valencia variable. Muchos de dichos agentes tienen la estructura AlCx(RCOO)yMz representado Alc por un metal alcalino o amonio; M es el metal de valencia variable, por ejemplo Fe, V, Mo, Ti; R es un radical orgánico, por ejemplo, -CH3, -CH2OH, -COO-, C6H5, donde x,y y z son números enteros. Del grupo de reveladores representados por esta formula, el oxalatoferrato (II) de potasio (ferroxalato de potasio), K2[Fe(C2O4)2}, tiene una importancia histórica considerable y se usa todavía en algún grado para trabajos científicos. Algunos reveladores orgánicos no caen dentro de esta clasificación, como la hidroxilamina; ciertos iones metálicos, por si solos actúan como agentes reveladores. El bromuro vanadioso, VBr2, es un agente revelador activo, y el sulfato ferroso actúa como revelador si la solución se mantiene en el estado reducido por contacto con polvo de cinc o de hierro. La función del radical orgánico en los reveladores del tipo oxalatoferrato (II)es formar con el estado mas oxidado del metal un complejo poco disociado, y por consiguiente suprimir la reacción inversa. El estado oxidado inferior del metal forma también un complejo con el ion orgánico, pero el ion esta retenido menos fuertemente en este complejo.
La mayor parte de los reveladores orgánicos tienen la estructura Kendall, a-(C=C)nb en le cual n es igual a cero o un numero entero, y a y b pueden ser un grupo hidróxido, un amino o un amino sustituido. Los reveladores mas sencillos abarcados por esta formula son aquellos en los que n=0; peróxido de hidrogeno, hidrazina e hidroxilamina. De ellos, la hidroxilamina es un buen revelador en condiciones apropiadas; el peróxido de hidrogeno y la hidrazina muestran acción de reveladores en condiciones mas restringidas.
La mayoría de los agentes reveladores útiles que tienen la estructura Kendall son compuestos aromáticos, principalmente derivados del benceno, pirocatecol, pirogalol y o-aminofenol (n=1); hidroquinona, clorohidroquinona, p-fenilenodiamina y diversos derivados N-sustituidos, p-aminofenol, N-(p-hidrofenil)glicina y p-metilaminofenol (n=2); hidrocerulignon (2,2',6,6'-tetrametoxi-p,p'-bifenol) (n=4), y diversos derivados de los mismos en los cuales uno o varios hidrógenos del núcleo bencenico han sido sustituidos por átomos o grupos de átomos, entre ellos hidróxido y amino. En general, la sustitución del hidrogeno o del grupo hidróxido por un grupo orgánico destruye el poder revelador, mientras la sustitución semejante en un grupo amino no destruye la actividad del revelado e incluso puede aumentarla.
Se conocen reveladores aromáticos que son derivados del naftaleno, el antraceno, el difenilo y otros hidrocarburos mas elevados. Estos tienen en su mayor parte una estructura Kendall. Se conocen; por ejemplo: el ácido ascorbico. Hay excepciones a la regla Kendall, compuestos que actúan como reveladores, pero que no tienen esta estructura; por ejemplo; el trimetilfloroglucinl, el 3-aminomesitol, la 1-fenil-3-pirazolidona y el 1,8-naftalenodiol. El rezorcinoles un revelador cuando se usa con un pH elevado y temperatura alta con emulsiones de bromuro de plata que pueden resistir estas condiciones.
Una solución reveladora típica contiene un agente revelador, un amortiguador, sulfito de sodio y bromuro de potasio. La mayoría de los reveladores orgánicos son suficientemente activos solo en solución alcalina, y su actividad varia con el pH. El amortiguador alcalino se utiliza para ajustar el pH a un valor apropiado y para mantenerlo en ese valor durante el uso. El sulfito de sodio funciona principalmente como preservativo y para impedir las manchas, aunque su acción disolvente sobre los haluros de plata tiene a menudo algún efecto sobre el curso del revelado. el sulfito disminuye notablemente la rapidez de la oxidación por el oxigeno en muchos reveladores orgánicos e impide la formación de productos coloreados en la oxidación. El bromuro actúa como antivelo, pues a menudo retarda la formación de niebla en un grado relativamente mayor de lo que retarda el revelado de la imagen. Los reveladores que utilizan agentes reveladores con un metal de valencia variable difieren de los orgánicos en que los primeros se usan en solución ácida sin el sulfito.
La hidroquinona, un representante del tipo HO-(CH=CH-)nOH se usa en la gran mayoría de los reveladores comerciales para la fotografía blanco y negro. La sustitución de uno o mas hidrógenos en el núcleo por -CH3, -OCH3, -Br, -Cl, -OH o -NH2 aumenta la actividad reveladora (rapidez del revelado a un pH dado), mientras que la sustitución por -SO3H, -COOH, -NO2 o -CHO disminuye la actividad y la 2,3dicianohidrtoquinona carece de la cualidad de revelador.
La hidroquinona es eficaz como revelador para las emulsiones de bromuro de plata solamente cuando se usa en solución alcalina. El agente revelador activo es el ion bivalente, y el aumento en la rapidez del revelado cuando aumenta el pH de la solución se explica por la concentración de este ion. Las solución alcalinas de hidroquinona son inestables con respecto al oxigeno. La oxidación de la hidroquinona se produce en por pasos sucesivos con la formación inicial de semiquinona, que es oxidada después y convertida en quinona, y se forma simultáneamente peróxido de hidrogeno. La quinona y el peróxido de hidrogeno reaccionan rápidamente para formar 2-hidroxi-1,4-quinona, que se polimeriza y convierte en ácido humico. La oxidación de hidroquinona es intensamente catalizada por vestigios de quinona. La quinnona reacciona con la hidroquinona para dar semiquinona, que es oxidada mas fácilmente que la hidroquinona.
Una solución que contenga a la vez hidroquinona y sulfito de sodio absorbe oxigeno con una rapidez menor que una solución de cualquiera de los dos agentes solos. El sulfito ejerce su acción inhibidora impidiendo la catálisis de la quinona. Lu Valle ha obtenido pruebas de que la semiquinona intermedia reacciona con el sulfito en una serie de pasos que terminan en la formación de monosulfonato de quinona. El mecanismo dela reacción no se ha elaborado au, pero la reacción total es representada cuantitativamente por la siguiente ecuación:
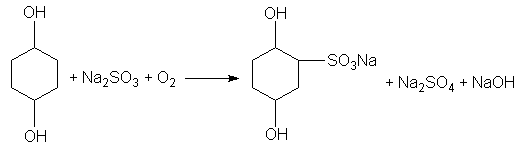
cuando el sulfito esta en suficiente exceso. La oxidación de la hidroquinona por el bromuro de plata es semejante en sus relaciones estequiometricas. En ausencia del sulfito se forma quinona, mientras que el monosulfonato se forma en presencia de sulfito según la ecuación:
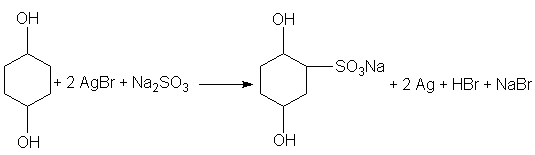
El monosulfonato reacciona con el oxigeno y el bromuro de plata de una manera semejante, y se forma el disulfonato. Sin embargo, el monsulfonato es un revelador mucho mas débil que la hidroquinona.
Como indican las ecuaciones anteriores, la oxidación de hidroquinona en presencia de sulfito da como resultado la formación de ion hidróxido cuando el oxidante es oxigeno, y la formación del ion hidrogeno cuando el oxidante es bromuro de plata. Puesto que la actividad de la solución reveladora depende bastante del pH, se acostumbra añadir un amortiguador para compensar en la medida de lo posible la alteración del pH durante el uso. El carbonato de sodio y el metaborato de sodio se usan como reguladores del pH para los reveladores de hidroquinona, y el bórax se usa en algunos reveladores cuando se desean valores mas bajos del pH. El bórax no puede usarse para los reveladores en los que los hidróxidos se encuentren en posición orto (como el pirocatecol y el pirogalol), ya que el bórax liga esos agentes por la formación de complejos y con ello disminuye mucho la acción reveladora, El fosfato trisodico amortigua entre limites mas altos de pH que el carbonato, pero el fosfato perjudica la propiedad endurecedora del baño fijador de alumbre, y eso limita su uso en los reveladores. Las soluciones reveladoras intensamente alcalinas se preparan con hidróxido de sodio o potasio.
Las reacciones de otros reveladores aromáticos del tipo dihidroxi son semejantes a las de la hidroquinona en muchos respectos, y se usa el sulfito de sodio como preservativo. El monosulfonato ha sido aislado como un producto de la reacción de varios de estos agentes.
Varios agentes reveladores importantes pertenecen al tipo HO-(CH=CH-)nNH2. Los mas sencillos, hidroxilamina, p-aminofenol, o-aminofenol, se venden en forma de clorhidratos y sulfatos, pues las sales son mucho mas estables en el estado libre que la base libre. la actividad del o-aminofenol es menor que la del derivado para, y su uso es mas limitado. El agente mas conocido de esta serie es el p-(metilamino)fenol, que , como sulfato(CH3NHC6H4OH)2H2SO4, se vende con los nombres comerciales de metol, elon, genol, y otros. El metol y la hidroquinona se usan muchos juntos como reveladores blanco y negro. El amidol (clorohidrato de 2,4-diaminofenol) es un revelador enérgico, incluso activo en solución neutra, y se utiliza a menudo con sulfito de sodio que desempeña el doble papel de preservativo y álcali. Otro agente en esta serie que se utiliza en la practica es la N-(p-hidroxifenil)glicina, HOC6H4NHCH2COOH, que se vende normalmente con el nombre de "glicina". Sus propiedades fotográficas se relacionan mas estrechamente con las de la hidroquinona que con las de la p-aminofenol.
Las velocidades del revelado por esos agentes y las velocidades de reacción con el oxigeno aumentan con el pH, y parece intervenir la ionización del grupo hidroxi. Lu Valle, Glass y Weissberger investigaron la oxidación por el oxigeno del p-aminofenol, el p-(metilamino)fenol y el p-(dimetilamino)fenol, y llegaron a la conclusión de que tanto la base libre como el anion reaccionan con el oxigeno. El sulfito inhibe la oxidación del revelador por el oxigeno y reacciona con el producto de la oxidación para formar un monosulfonato. El monosulfonato también se forma cuando el revelador es oxidado por el bromuro de plata en presencia de sulfito. Lehmann y Tausch dan la siguiente reacción, que representa cuantitativamente la reacción del bromuro de plata con el p-(metilamino)fenol en presencia suficiente de sulfito:
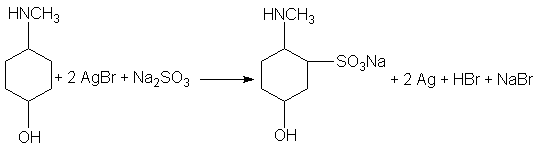
El tipo H2N-(CH=CH-)nNH2 incluye la p-fenilenodiamina, H2NC6H4NH2, y un grupo de sus derivados útiles en revelado con copulador de color. La p-fenilenodiamina se usa algo como revelador de grano fino y en la preparación de reveladores físicos. Los reveladores de color mas útiles son N,N- dialquil-p-fenilenodiaminas, que suelen ser mas activas que la propia p-fenilenodiamina. Tanto la p-fenilenodiamina como sus derivados N-alquilicos producen en algunas personas dermatitis de sensibilizacion semejante a la producida por la hiedra venenosa. Sin embargo, la sustitución de un hidrogeno aminico por un grupo 2-metilsulfonamidoetil, CH3SO2NHCH2CH2- y otros grupos disminuyen mucho la acción alérgica (por ejemplo, la N-[2-(4-amino-N-etilanilino)etil]metanosulfonamida, CH3SO2NHCH2CH2N(C2H5)C6H4NH2, es mucho menos peligrosa que la N,N-dietil-p-fenilenodiamina) sin amenguar su actividad fotográfica. La p-fenilenodiamina, y muchos de sus derivados forman monosulfonatos por oxidación en presencia de sulfito, que actúa también como preservativo contra la oxidación por el oxigeno.
La relación entre la actividad y la estructura ha sido estudiada para gran parte de los derivados de la p-fenlenodiamina. La actividad de N,N-dietil-p-fenilenodiaminas sustituidas en el anillos disminuyen en el siguiente orden: 3-OH,3NH2, 3NHC6H5, 3NHSO2CH3, 3-N(CH3)2, 3,5-(CH3)2, 3-CH3, 3-NHCOCH3, 3-OC2H5, H, 3-C2H4NHSO2CH3, 3-C2H4NHCOCH3, 3-OCH3, 3-CH2OH, 3-CH2NHSO2CH3, 3Cl, 2-OCH3, 2-NH2, 2CH3, 2NHCOCH3. Reemplazando uno de los etilos en la N,N-dietil-p-fenilenodiamina por R, la actividad disminuye en el orden siguiente: R= C3H7, C2H4NH2, C2H4OH, CH3, C2H4NHSO2CH3, C2H4NHCOCH3, C2H4N(CH3)SO2CH3, C2H4OC2H5, CH2ONH2. La N,N'-dimetil-p-fenilenodiamina es un revelador para blanco y negro mas activo que el compuesto N,N'dietilico. Los productos de oxidación de muchos de estos compuestos interfieren en el revelado, y la actividad es aumentada por la presencia de sulfito o copuladores que reaccionan con los productos de oxidación. Se observo una relación grosera entre la actividad del revelador y los potenciales polaragraficos de media onda de los derivados de la p- fenilenodiamina. Las reacciones de los reveladores a base de p-fenilenodiamina conducen a la formación de colorantes.
Fotografía Caucho Energía solar Polímeros Antibióticos Cambio climático Petróleo Emulsiones